|
|
 |
 |
|
|
 |
| |
-国際学会誌の表紙を飾る-
|
| |
|
| |
写真をクリックすると拡大写真がご覧いただけます。
|
| |
 |
| |
https://www.springer.com/life+sciences/cell+biology/book/978-1-60761-782-2

Immunoelectron Microscopy
Methods and Protocols
Series: Methods in Molecular Biology, Vol. 657
Schwartzbach, Steven D.; Osafune, Tetsuaki (Eds.)
1st Edition., 2010, XI, 352 p. 82 illus., 41 in color., Hardcover
ISBN: 978-1-60761-782-2

Due: July 29, 2010
152,01$
About this book
Immunoelectron microscopy is a key technique that bridges the information
gap between biochemistry, molecular biology, and ultrastructural
studies placing macromolecular functions within a cellular context.
In Immunoelectron Microscopy: Methods and Protocols, expert researchers
combine the tools of the molecular biologist with those of the microscopist.
From the molecular biology toolbox, this volume presents methods
for antigen production by protein expression in bacterial cells,
methods for epitope tagged protein expression in plant and animal
cells allowing protein localization in the absence of protein specific
antibodies as well as methods for the production of anti-peptide,
monoclonal, and polyclonal antibodies. From the microscopy toolbox,
sample preparation methods for cells, plant, and animal tissue are
presented. Both cryo-methods, which have the advantage of retaining
protein antigenicity at the expense of ultrastructural integrity,
as well as chemical fixation methods that maintain structural integrity
while sacrificing protein antigenicity have been included, with
chapters examining various aspects of immunogold labeling. Written
in the highly successful Methods in Molecular Biology? series format,
chapters include introductions to their respective topics, lists
of the necessary materials and reagents, step-by-step, readily reproducible
laboratory protocols, and notes on troubleshooting and avoiding
known pitfalls. Authoritative and essential, Immunoelectron Microscopy:
Methods and Protocols seeks to facilitate an increased understanding
of structure function relationships.
Content Level " Professional/practitioner
Keywords " Fixation protocols - Macromolecular functions -
Pre- and post-embedding immunogold labeling - Structure function
relationships
Related subjects " Cell Biology - Immunology
|
| |
|
| |
ユーグレナの "巨大葉緑体"の発見 |
| |
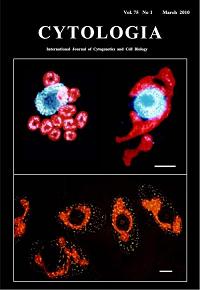 Formation
of "giant chloroplast" during the cell cycle of Euglena
gracilis Z in synchronized culture Formation
of "giant chloroplast" during the cell cycle of Euglena
gracilis Z in synchronized culture
Osafune,T,,Tanaka,K. and Ehara,T.
Cytorogia, Vol.74,1,(2010)
In the cell cycle of Euglena gracilis Z in synchronized
cultures, chloroplasts temporarily conjoin to form a single giant
structure at the 14th hour after the onset of the light period,
called "giant chloroplast" (upper in right and bottom),
which surrounds the nucleus making connections or close contacts
at several sites. The upper left shows the 10th hour after the onset
of the light period. The cell contained 11 chloroplasts and chloroplasts
were round or oval in shapes and dispersed in the cytoplasm. Chloroplast
nucleoids in the "giant chloroplast", observed under a
fluorescence microscope after staining with DAPI, the DNA fluorochrome,
become stringy and some tips of the string appeared to come into
close proximity to the site of connection with the nucleus (upper
in right). Bar (upper, bottom: 5mm).
|
| |
|
| |
同調培養ユーグレナの"巨大葉緑体"の形成 |
| |
 Ehara,T.,Osafune,T.,Hase,
E.: Ehara,T.,Osafune,T.,Hase,
E.:
Interactions between the nucleus and cytoplasmic organelles during
the cell cycle of Euglena gracilis in synchronous cultures.
Exp. Cell Res.190(1)104-112, (1990)
先に、Osafuneらは単細胞微細緑藻クラミドモナスの同調培養集団におけるミトコンドリアの形態を追跡し、複数個の小型ミトコンドリアが相互融合によって巨大ミトコンドリア形成され、
同時に呼吸活性が一時的に低下する現象をみいだした。 私たちは、このような現象は葉緑体でも起りうるものと推測し、複数個の葉緑体を有する単細胞鞭毛藻ユーグレナで調査した。
その結果、 ユーグレナのcell cycle中の初期と細胞分裂前とに、一時的に"巨大葉緑体"が出現すことをみいだした。
そして、 葉緑体のダイナミックな動態を最初にcell cycle中に位置付けた。
|
| |
|
| |
ユーグレナのLHCII タンパク質分子はゴルジ体を経由する |
| |

Schwartzbach,S.D., Osafune, T., Löffelhardt, W.:
Protein import into cyanelles and complex chloroplasts.
Plant Molecular Biology. 382(2)263-274 (1998)
光化学系IIに光を集める集光性クロロフィルa/b結合タンパク質複合体(LHCII)は細胞核にコードされて細胞質で合成され、
何らかの方法によって葉緑体に運ばれた後、 2段階のプロセッシングを受けてチラコイド膜に組込まれることが知られている。私たちはユーグレナを同調培養し、
LHCII タンパク質分子の細胞内の動態を免疫電顕法とコンピュータ・グラフィックスとで追跡し、 LHCIIタンパク質分子がゴルジ体を経由して,
葉緑体チラコイド膜に輸送される現象を最初にみいだした (Osafune,et al.:Exp.Cell Res.193:320-330,1991)。
このような新事実は誰も予想しなかった発見で、今後の新たなる研究が展開するものと思われる。
|
| |
|
| |
ユーグレナのプラスチドとプロラメラ体の3次元再構築 |
| |

Osafune,T.,Ehara,T.,Sumida,S.,Hase,E., Schiff,J.A.:
Light-independent processes in the formation of thylakoids and pyrenoids
in proplastids of dark-grown cells of Euglena gracilis.
J. Electron Microscopy. 39(4)245-253, (1990)
先に、 Euglena gracilis Zは適切な前培養条件を選べば、
暗所でプロプラスチド構造の発達が起こることをみいだした。 本論文は連続超薄切片法-電子顕微鏡、 コンピュータ・グラフィックス画像解析装置を用いて、ユーグレナの葉緑体形成の初期暗過程におけるプラスチドの微細構造の変化を経時的に追跡したものである。 写真は144時間後のプロプラスチド構造である。 従来、
ピレノイドは光の誘導により形成されると考えられてきた(Klein)。 一方、 私たちのグループは概説を覆し、案出した葉緑体形成初期暗過程の観察可能な実験系および画像解析装置を用いて、ピレノイドが暗所でも形成されることを明らかにした。
|
| |
|
| |
LHCII タンパク質分子の細胞内3次元分布 |
| |
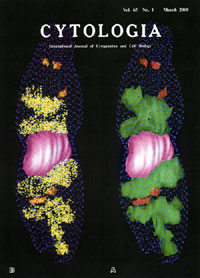
Osafune,T.:
A three-dimensional computer generated model of synchronously dividing
Euglena gracilis Z cell at light/dark cycle constructed based
on serial sections.
Cytologia. 67,(1)1-2,
(2000)
同調培養したEuglena gracilis Zを免疫電顕法とコンピュータ・グラフィックス画像解析により、 細胞とLHCII タンパク質分子を
3次元再構築したものである。 黄色に示したドットはLHCIIタンパク質分子で、細胞内の配置が3次元的に表示されている。すなわち、 LHCIIは葉緑体と全てのゴルジ体に局在していることが判る。
3次元的に構築された像はディスプレイ画面上で任意の角度で割断し、 断面像の観察や像の拡大、縮小、 移動や回転をすることが可能である。
黄色ドットはLHCIIタンパク質分子。 ピンクは細胞核、 緑色は葉緑体、 赤色はゴルジ体、 青色のドットは細胞質膜を示している。
|
| |
|
| |
ユーグレナのRuBisCO酵素の細胞内 3次元分布 |
| |

Osafune,T.,Sumida,S.,Ehara,T.,Hase,E.:
Three-dimensional distribution of ribulose-1,5-bisphosphate carboxylase
oxygenase in chloroplasts of actively photosynthesizing cell of Euglena
gracilis.
J. Electron Microscopy,38(5)399-402, (1989)
Euglena gracilis Z細胞のribulose-1,5-bisphosphate
carboxylase oxygenase(RuBisCO)を連続超薄切片法、免疫電顕法およびコンピュータ・グラフィクス画像解析によって、細胞内の
3次分布を明らかにした。このような分子細胞形態学的研究手法で、光合成炭酸固定反応の主要酵素であるRuBisCOの約 80%がピレノイドに局在することを確定した。
すなわち、 それまでのRuBisCOについての推測また解釈に、事実をもって定量的な回答を与えた最初の論文である。ドットはRuBisCO、緑色は葉緑体を示している。
|
|