 |

|
|
|
 |
| |
-研究歴と研究活動-
|
| |
|
| |
|
|
| |
理学博士 医学博士
長舩 哲齊
|
招待講演・中央アメリカ国際電子顕微鏡学会
ロザリオ市 アルゼンチン 2009年10月27日
|
| |
|
 |
 |
| |
研究歴 |
 |
 |
|
|
米国ブランダイス大学留学 (Abraham & Etta Professor Jerome A. Schiff研究室),
東京大学応用微生物研究所 (長谷栄二研究室)
|
| |
米国ブランダイス大学光生物細胞小器官研究所 客員研究員, |
| |
東京医科大学 医学部助教授. |
| |
1994年 日本体育大学 教授 |
| |
1995年 東京大学 非常勤講師 |
| |
2001年 名古屋大学 客員教授 (併任) |
| |
|
| |
現 職 (2002年12月, 現在) |
| |
| アジア太平洋電子顕微鏡学会議 組織委員会委員 |
| ユーグレナ研究会 幹事 |
| 社団法人 日本電子顕微鏡学会 理事 |
| 日本植物形態学会 評議員 |
| 日本植物形態学会 学会賞選考委員 |
| 社団法人 日本電子顕微鏡学会 評議員 |
| 社団法人 日本電子顕微鏡学会学会賞 瀬藤賞選考委員 |
| 社団法人 日本電子顕微鏡学会 関東支部幹事 |
| 社団法人 日本電子顕微鏡学会 関東支部評議員 |
| 社団法人 日本電子顕微鏡学会 英文誌編集委員 |
Journal of Electron Microscopy, Executive Editor,
Oxford University Press. |
| 社団法人 日本顕微鏡学会 平成15・16年度関東支部副支部長 |
| 財団法人 日本メンデル協会 評議員 |
|
| |
|
| |
|
| |
日本学術振興会 |
| |
|
| |
国際電子顕微鏡学会 |
| |
|
| |
日本顕微鏡学会
|
| |
|
| |
Journal of Electron Microscopy |
| |
|
| |
|
| |
日本顕微鏡学会関東支部 |
| |
|
 |
 |
| |
|
| |

恩師 J.A. Schiff先生御自宅で
写真左側:長舩哲齊 教授、 写真中央:
Abraham Etta Goodman Professor
Dr.Jerome A. Schiff
The Institute of Photobiology of Cells
and Organelles, Brandeis University,
Waltham, MA. USA
|

米国ブランダイス大学・光生物学細胞オルガネラ研究室
|
| |
|
| |
同調培養微細藻類のオルガネラの動態 |
| |
同調培養した細胞集団を経時的に観察することによって、 生活環(life cycle)の運行にともなうオルガネラの超微細構造の変化や遺伝子および酵素などの発現について、生活環中の一定の時期に、
特定のステージへ位置付けることができる。 その結果、 オルガネラの構造変化と生理生化学的変化とを直接、 結び付けて考察することが可能になる。
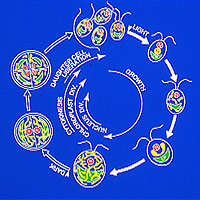
私たちは同調培養した単細胞緑藻クラミドモナスや鞭毛藻ユーグレナのミトコンドリアの動態を電子顕微鏡で追跡し、 生活環の成長期にミトコンドリアの相互融合によって
"巨大ミトコンドリア" が一時的に形成され(図1)、同時に呼吸による酸素吸収能が低下する現象を最初にみいだした。 この発見は、同時に、
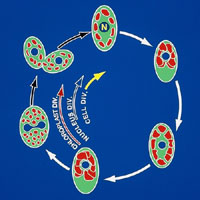
その後の研究発展の原点ともいうべきものであり、複数個の葉緑体をもつユーグレナ細胞にも着目し、それらの動態の追跡から "巨大葉緑体"
が形成される現象をみいだした(図2)。 現在、 生活環中にみられる"巨大ミトコンドリア"および"巨大葉緑体"が生活環の特定のステージで形成される意義についての解明を行っている。
|
| |
|
| |
| (図1)ミトコンドリア・サイクル |
|
(図2)葉緑体・サイクル |
|
|
 |
| ミトコンドリア・サイクルで、"巨大ミトコンドリア"が一時的に形成される現象をみいだし、
生活環中に最初に位置づけた。 |
|
複数個の葉緑体を有するユーグレナ細胞を用いて、その生活環中に"巨大葉緑体"が特異的に出現する現象をみいだした。 |
|
| |
|
| |
ユーグレナの葉緑体形成過程に関する研究
|
| |
ユーグレナ細胞では、 色素体(葉緑体)が培養の際の栄養条件の如何によって、
退化と再形成を繰り返すことが知られている。 従来から、ユーグレナの葉緑体形成過程に関する研究は光の照射によって、葉緑体の発達過程を誘導する実験が行われてきた。
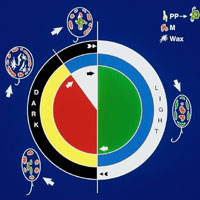
この方法を利用する限り、 葉緑体発達の初期暗過程は研究することは不可能であった。 私たちの研究室では、ユーグレナの培養に際しての栄養条件を検討し、
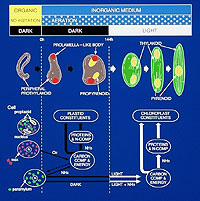
独自の実験系を開発した(図3)。 その結果、 葉緑体形成の初期暗過程と、 光に依存する葉緑体形成の明過程とに分けて、葉緑体発達過程を追跡することを可能にした(図4)。
これによって、光合成炭酸固定の主要酵素であるリブロース-1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼの集合体である"ピレノイド"が、従来の認識と異なり、光に依存することなく暗所で形成される現象を最初に明らかにした。
現在、 私たちが確立した実験系を用いて、 ユーグレナの連続超薄切片作製法, 電子顕微鏡観察, コンピュタ・グラフィックス画像解析により、葉緑体発達の経時的な形態変化や光合成タンパク質分子の細胞内の3次元配置を分子細胞形態学的に追究している。 |
| |
|
| |
| (図3)葉緑体の可逆的な退化と再形成 |
|
(図4)葉緑体形成の初期暗過程と明過程 |
|
|
|
| 研究室では、ユーグレナの前培養条件を適切に選べば、
細胞を暗所で有機炭素源を除いた無機培地に移すことにより、初めて葉緑体形成の初期暗過程が観察できる実験系を樹立した。 |
|
| |
|
| |
タンパク質分子の細胞内輸送経路の解析 |
| |
生命現象の解明には、 分子生物学的アプローチが大きな成果を収めてきたことはよく知られている。 しかし、
生命の動的な分子全体のダイナミクスを解明するには形態学的アプローチなくしては成り立たないことも事実である。
私たちは免疫電顕法により、 ユーグレナの光合成酵素の多くはどこから、どのようにして葉緑体へ運ばれ、ユーグレナ特有の 3層構造の葉緑体包膜をどのように通過するのか。
また、 それらのタンパク質分子はどのようにして複雑な構造をもった葉緑体に特異的に組込まれ、機能が発現されるようになるのかなどに興味をもっている。
その中の一つの研究では、細胞核にコードされ細胞質で合成される光化学系II・集光性クロロフィルa/b結合タンパク質複合体の細胞内の移動を免疫電顕法で追跡し、それがゴルジ装置(図5)を経由して、
葉緑体チラコイド膜に移送される現象を最初にみいだした。 さらに、 コンピュタ・グラフィックスで画像解析し、それらを裏付けた(国際誌の表紙1を参照)。
図6のスキームは輸送経路をまとめたものである。 現在、 このような現象について、 ミトコンドリア等についても同じように免疫電顕法を用いて調査している。 |
| |
|
| |
| (図5)LHCIIのゴルジ装置への局在性 |
|
(図6)LHCIIの葉緑体への輸送経路 |
|
|
|
|
| LHCIIタンパク質分子の配置が15nmのゴールド粒子で可視化され、ゴルジ装置の上に観察される。 |
|
ユーグレナのLHCIIタンパク質分子がゴルジ装置を経由し、葉緑体へ輸送される現象を最初に見いだした。 |
|